研究実施管理
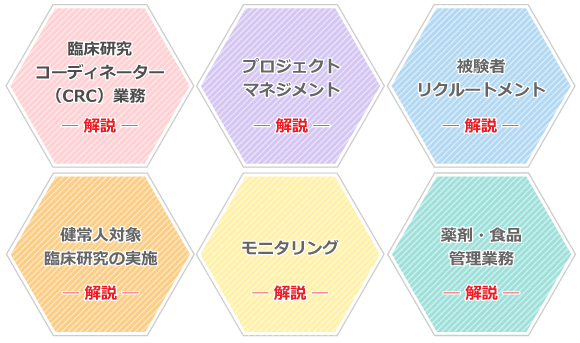
臨床研究の支援として6つの業務が体制を整えております。
各業務の詳細については、以下のボタンからリンク先をご確認ください。
また、臨床研究支援の一環として、学内アカデミアの皆様へ、被験者リクルートメント用チラシを始めとする各種のテンプレートや動画をご用意しています。
ご希望の方は「お役立ちツール利用申込フォーム」からお申込み下さい。
お役立ちツール利用申込フォームは2カ月に1度メンテナンスが発生します。
アクセス出来ない場合は2時間程度時間を空けてアクセスして下さい。
CRC業務
臨床研究コーディネーター(CRC)による支援の必要性
- 診療をしながら臨床研究の内容を十分把握し、必要な情報を適切な時期に確実に収集することは簡単なものではありません。
- 研究者に支援についての調査を実施したところ、「患者スケジュール管理」、「症例報告書記入、クエリー対応」の支援を求める声が最も多くありました。
今後、規制が厳しくなっていく中、計画書に記載されている規制を遵守するためにも、コーディネーターによる支援は不可欠です。
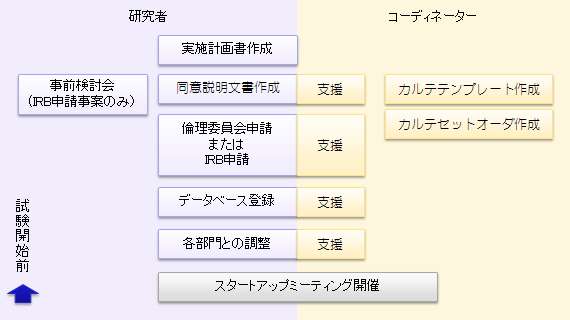
臨床研究コーディネーター業務(CRC業務)のサービスフロー
プロジェクトマネジメント(調整事務局)業務
支援業務には以下のような項目があります。このうちご相談に応じて必要な部分を支援します。
試験開始前
① 計画立案から試験概要確定時の支援
- 研究費の申請等に係る手続き
- PMDA薬事戦略相談(申請書、資料作成等)
② 研究組織構築から各種試験関連文書の作成
- 試験実施体制の構築(調整委員会、効果・安全性評価委員会、中央判定委員選定や設置記録等作成)
- 各種文書(試験実施計画書、説明同意文書雛形、各SOP等)の作成
- 安全性情報取扱体制の構築(薬剤提供者との交渉、SOPの作成)
- キックオフミーティングの開催支援
③ 倫理委員会
- 実施医療機関の倫理委員会申請支援
試験実施中
- 臨床試験登録/変更手続き(UMIN等)
- 契約締結手続き(実施医療機関、薬剤配送等外注先との契約締結における、契約書案の作成や締結先との交渉等)
- 薬剤配送手続き、管理
- 登録進捗管理(登録一覧表の作成、配信、登録推進業務)
- 実施医療機関等からの問合せ対応(問合せ窓口、FAQ作成)
- 安全性情報対応(医療機関、薬剤提供者、規制当局等への規定に則った報告支援)
- モニタリング(セントラル/オンサイトモニタリングの実施および実施状況確認)
- 監査対応(施設決定、実施医療機関と監査担当者との調整、監査報告に対する対応検討等)
- 各委員会開催支援(効安、中央判定委員会等。会議資料、議事録の作成と報告先への報告)
- 各種文書(試験実施計画書、説明同意文書雛形、各SOP等)の改訂
- 問題症例の取扱い、症例データの取扱いに関する実施医療機関間の調整
- 試験中に生じた試験実施計画書等の解釈上の疑義の調整
- 開発業務受託機関(CRO)等への業務委託に係る調整
- モニタリング
- 監査
- データマネジメント
- 統計解析
- その他の業務
- 記録の保存等に係る調整
- 試験の中止に係る調整
- 研究費取り扱い(公的研究費の継続申請、年次報告書作成、支出管理等)
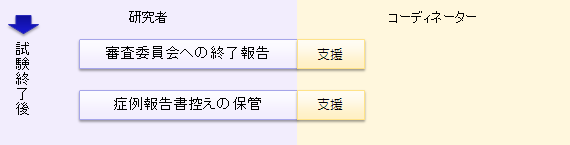
試験終了時
- 薬剤回収/廃棄
- 症例検討会の開催支援(会議資料、議事録の作成と報告先への報告)
- 薬剤提供者への報告
臨床試験のニュースレター発行

サーバーにてファイル管理と情報共有

臨床試験の実施医療機関準備支援
(REDCap活用)
よくある質問(FAQ)の公開
(REDCap活用)
被験者リクルートメント
おおさか臨床試験ボランティアの会の活用
臨床研究・イノベーション推進センターでは、「おおさか臨床試験ボランティアの会」を運営しています。
研究者主導の臨床試験の参加者を募集したい、あるいは、一般市民対象の講演会のお知らせをしたい、ということはありませんか?
四半期ごとに会員向けに情報発信(メールマガジン発行)をしていますので、チラシやリーフレットを同封してお送りすることができます。
臨床研究に本会を活用したいとお考えの研究者の方々は、是非、お気軽にお問い合わせください。

コールセンター受付対応
参加希望者の受付窓口としてコールセンターを設置して、問い合わせ対応をしたり、参加申し込みの受付を行ったりします。ある程度の適格基準の確認を行い、来院当日のご案内をすることもできます。 申込用のwebsiteを開設してウェブ申し込みができるような対応もしております。
健常人対象臨床研究の実施
当センターでは、健常人を対象とする試験の実施を支援しています。これまでに実施した健常人対象の試験には食品試験、機器、観察研究などがあります。
- 健常候補者の募集には、当センターで管理している「おおさか臨床試験ボランティアの会」の会員を中心に情報発信します。コールセンターを立ち上げて受け付けますので、適格性を満たす候補者を適切に集めます。
- 試験実施は大阪公立大学医学部附属病院で実施します。通常は、土日祝日の昼間の時間に実施しています。実施内容によって適切な実施場所を選択し、確保します。
これまでの実績(健常人を対象としたさまざまな試験)はこちらをご覧ください。
モニタリング
研究の品質確保の一環として、オンサイトまたはオフサイトモニタリングを実施します。
大きな目的としては、以下があげられます。
- 実施医療機関および責任医師選定のための適格性の調査
- GCP、倫理指針などの適切な法令、並びに試験実施計画書を遵守して実施されていることの確認
- 依頼者/研究代表者と各実施医療機関の責任医師との間の情報交換
支援業務には以下のような項目があります。このうちご相談に応じて必要な部分を支援します。
試験開始前
- 実施医療機関および責任医師選定における責任医師の要件確認、実施医療機関の要件確認 など
- 実施計画書合意書の確認
- 倫理委員会手順書確認、委員名簿の確認
- 契約書の確認スタートアップミーティングにて試験に参加するスタッフに対して、試験の具体的手順を説明し、理解の統一を図るとともに情報を共有 など
試験実施中
- 試験薬の搬入記録の確認、手順書等の必要書類の確認
- 登録症例の同意取得の確認
- 被験者選定の確認
- データの回収促進、確認、修正依頼
- 試験計画者、GCP/指針などの遵守状況の確認
- 試験薬使用状況の確認
- 必須文書の保存の確認
- 安全性情報の収集・提供確認 など
試験終了時
- 薬剤回収またはその確認
- 終了報告の確認
- 必須文書の保存の確認 など
薬剤・食品管理業務
臨床試験用薬剤(白箱)、食品の管理
保管場所が確保できない、ということはしばしば発生します。当センターが本業務を支援する場合は、治験薬管理室内で適切に管理をいたします。
ICH-GCP対応などで、温度管理、危機管理などの記録が求められる場合にも対応いたします。

これまでの実績(健常人を対象としたさまざまな試験)はこちらをご覧ください。