製造販売後調査の実施
概要
大阪公立大学医学部附属病院での製造販売後調査および申請方法についてご説明します。
なお、副作用調査につきましては、担当者までお問い合わせください。
なお、副作用調査につきましては、担当者までお問い合わせください。
一般使用成績調査とは
- 医薬品及び医療機器等を使用する患者の条件を定めることなく、副作用による疾病等の種類別の発現状況並びに品質、有効性及び安全性に関する情報の検出又は確認をおこなう調査です。
特定使用成績調査とは
- 使用成績調査のうち、小児、高齢者、妊産婦、腎機能障害又は肝機能障害を有する患者、医薬品を長期に使用する患者、その他医薬品を使用する条件が定められた患者における副作用による疾病等の種類別の発現状況並びに品質、有効性及び安全性に関する情報の検出又は確認をおこなう調査です。
副作用・感染症調査とは
- 薬事法の改正により企業や医療機関が医薬品の副作用、医療機器の不具合やこれらによる感染症などについて厚生労働省に報告することが法制化されました。
具体的には医薬品において、以下の様な事象が発生した場合が対象になります。
- 死亡、障害、治療のため入院または入院の延長が起こったとき
- 患者の子に先天異常が認められたとき
- 感染症が起こったとき
- 添付書類に記載されていない事象が起こったとき。
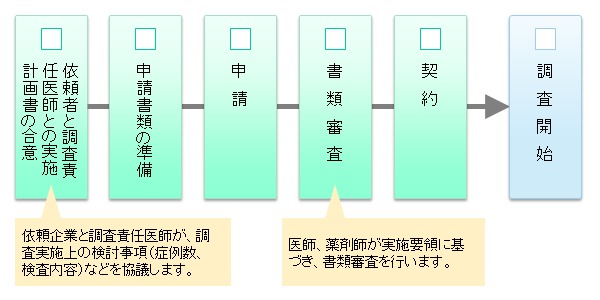
調査開始までの流れ
製造販売後調査の実施までの流れは以下のようになります。

手続き
概要
申込は、随時受け付けております。手続きの手引きを作成しましたので、ご参照ください。
提出書類等
提出書類:様式1,様式3を変更しました。提出書類:※CRO業務委受託覚書(雛形)を追加しました。
| 様式番号 | 資料名 | 新規申請 | 変更申請 |
|---|---|---|---|
| 様式1 | 調査委託申込書 | 1部 | |
| 様式2 | 調査委託一部変更届 | 1部 | |
様式3-1 様式3-2 様式3-3 |
製造販売後調査等契約書 注) ・契約書(医薬品) ・契約書(医療機器) ・契約書(再生医療等製品) |
2部 | |
| 様式4 | 製造販売後調査等変更契約書 | 2部 | |
| 様式11 | CRO業務委受託覚書(雛形) | 必要時(3部) | |
| 調査実施計画書(実施要綱)※ | 1部 | ||
| 調査票 ※ | 1部 | ||
| 返信用封筒(郵送希望の場合) | 1部 | 1部 | |
| 担当者 名刺 | 1部 | 1部 | |
| 様式番号 | 資料名 | 変更申請 |
|---|---|---|
| 様式2-1 | 調査委託一部変更届 | 1部 |
| 様式4-1 | 製造販売後調査等変更契約書 | 2部 |
| 返信用封筒(郵送希望の場合) | 1部 | |
| 担当者 名刺 | 1部 |
注)契約書 記入上の注意点
下記条文に貴社の指針名または、ガイドライン名を必ず記入して下さい。
(透明性の確保)
第11条 甲は、乙が日本製薬工業協会の定める「企業活動と医療機関等の関係の透明性ガイドライン(平成23年1月19日)」を受けて策定した乙の「○○○○○○○○」に基づき、甲が本契約に従い乙から支払いを受けた対価及び甲の医療機関名等について、これを乙のウェブサイト等で公開することに同意するものとする。
下記条文に貴社の指針名または、ガイドライン名を必ず記入して下さい。
(透明性の確保)
第11条 甲は、乙が日本製薬工業協会の定める「企業活動と医療機関等の関係の透明性ガイドライン(平成23年1月19日)」を受けて策定した乙の「○○○○○○○○」に基づき、甲が本契約に従い乙から支払いを受けた対価及び甲の医療機関名等について、これを乙のウェブサイト等で公開することに同意するものとする。
提出先・お問い合わせ先
- 新規申し込み、提出期限、提出書類など、詳しくは以下の担当までお問い合わせ下さい。
- 【製造販売後調査担当】
〒545-0051
大阪市阿倍野区旭町1-2-7 あべのメディックス6F
大阪公立大学医学部附属病院 臨床研究・イノベーション推進センター
製造販売後調査担当
TEL:06-6645-3447
FAX:06-6645-3448
製造販売後調査お問い合わせ専用メールアドレス:med-seihango★ml.omu.ac.jp
※メールアドレスの★を@に変更してから送信してください。
一部変更手続き
- 実施計画内容、調査期間、症例数等に変更が生じる場合は、一部変更の手続きが必要です。新規と同じく随時受付しております。
- 特に期間を延長される場合は、余裕をもって手続きをお願いいたします。
担当医師の変更等について
- 責任医師変更の場合は、変更契約の手続きが必要です。分担医師追加・削除等変更の場合は、製造販売後調査お問い合わせ専用メールアドレスに追加・削除となる日付、分担医師の氏名を記載し、送付をお願いいたします。
申請手続きに関する注意事項
(1)依頼者と調査責任医師による実施計画書の合意
- 調査には、調査責任医師の合意が前提になります。
(2)申請手続き
- 申請書類は、臨床研究・イノベーション推進センターに提出してください。
- 申請書類は公立大学医学部附属病院臨床研究・イノベーション推進センターホ-ムページからダウンロードしてご利用ください。
- 調査委託申込書(様式1)、調査委託一部変更届(様式2、 様式2-1)は所定の項目を記載し、教室責任者並びに調査責任医師の印を押して提出してください。
- 製造販売後調査等契約書(様式3-1、様式3-2、様式3-3)、製造販売後調査等変更契約書(様式4、様式4-1)は2部用意し、それぞれに記名し、社印を押して提出してください。
- 契約締結日は空欄にしておいてください。(承認後、当院が記入します。)
- 経費の算定方法は「一般使用成績調査・特定使用成績調査に係る経費算定表」または「副作用・感染症調査算定表」をご参照ください。
(3)契約
- 契約締結後、調査委託承認書(様式5)及び契約書をお渡しします。
(4)調査開始
- 調査の開始は契約締結後になります。
- 毎年1回(11月~12月ごろ予定)、製造販売後調査の実施状況について調査を実施します。
- 実施症例数に応じて請求書を発行しますので、指定口座にお振込みください。
(5)調査終了
- 調査が終了したときは、担当者に連絡してください。
- 調査終了確認後、製造販売後調査終了(中止・中断)通知書(様式8)を発行します。
- 調査終了後、請求書を発行し納付用紙と共に送付しますので、速やかに指定口座にお振込みください。