治験・製造販売後臨床試験の実施
概要
大阪公立大学医学部附属病院 臨床研究・イノベーション推進センター(以下、当センターと略します)では、安全で効果的な新薬の開発等を円滑に進めるために、GCPに基づく治験・製造販売後臨床試験を受託しております。
大阪公立大学医学部附属病院は、病床数や立地など、スムーズで効率の良い治験を実施するために有利な条件が多くあります。
是非、当院の恵まれた環境と当センターの豊富なノウハウをご活用ください。
大阪公立大学医学部附属病院は、病床数や立地など、スムーズで効率の良い治験を実施するために有利な条件が多くあります。
是非、当院の恵まれた環境と当センターの豊富なノウハウをご活用ください。
- 900床を超える病床数を有する特定機能病院。(2019年4月現在)
- 大阪市の南のターミナルである天王寺駅から徒歩数分の立地。
- 37の診療科、20を超える中央部門などの診療体制。(2019年4月現在)
- 治験の計画から報告まで一貫したサポートを提供する臨床研究・イノベーション推進センターを設置。
- 看護師、薬剤師、臨床検査技師など多職種からなる専任の治験コーディネーターを配置。
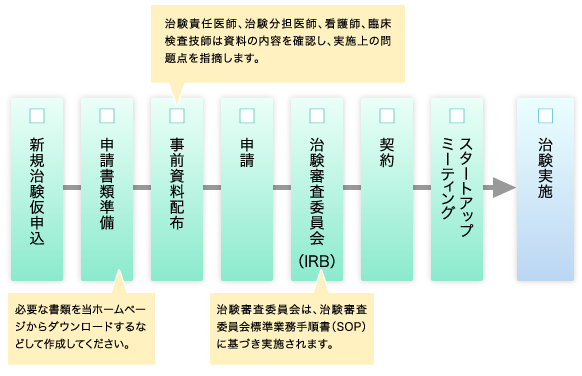
治験実施までの流れ
治験の標準業務手順(SOP)
手続き
カットドゥスクエア関連資料
Agatha関連資料
新規申請
最初のご相談・仮申込は、IRBでの審議をご希望の日程の約2ヶ月前までにお済ませください。治験の新規申請手続きの手引きを作成しましたので、ご参照ください。
上の手引きをご熟読の上、以下の表の各様式を必要に応じてダウンロードし、次の治験手続き関連書類(統一様式)の運用・作成に関する手順書を参考に、申請書類を作成してください。
当院で実施する治験において、治験責任医師、治験分担医師になれる医師の要件を次の書類にまとめておりますので、ご一読の上、適格な医師にご依頼くださいますようお願いします。
契約および経費納入に関する手続きについては、次の書類をご参照ください。
提出書類等
当院は統一書式を使用しています。統一書式については、新たな「治験の 依頼等に係る統一書式について」 (平成24年3月7日医政研発0307第1号、薬食審査発0307第2号及びその後の改正を含む)で定められた様式を使用してください。
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/promote.html
| 様式番号 | 資料名 | 大阪公大書式7 | 治験実施計画書からの逸脱記録 |
|---|
| 様式番号 | 資料名 |
|---|---|
| 臨床試験研究経費ポイント算出表 | |
| 臨床試験研究経費ポイント算出表(医療機器) | |
| 治験使用薬管理経費ポイント算出表 | |
| 大阪公大経費様式1 | 経費算定表 |
| 大阪公大経費様式2 | 症例数確定報告書 |
提出先・お問い合わせ先
- 新規申し込み、期限、提出書類など、詳しくは以下の担当までお問い合せ下さい。
- 〒545-0051
大阪市阿倍野区旭町1-2-7 あべのメディックス6F
大阪公立大学医学部附属病院 臨床研究・イノベーション推進センター
【治験事務局】
〒545-0051 大阪市阿倍野区旭町1-2-7 あべのメディックス6F
TEL:06-6645-3447 FAX:06-6645-3448
新規治験お問い合わせ専用メールアドレス:med-shinki★ml.omu.ac.jp
※メールアドレスの★を@に変更してから送信してください。
新規契約締結以降の対応について
- 契約の締結完了後は、以下の書類を参考になさってください。
・新規契約締結以降の対応について
・治験事務局業務担当者一覧
この書類には、注意事項、安全性情報、変更申請、継続審査、症例数確定後の手続き、終了方法、カルテ閲覧、必須文書閲覧、監査などについての情報がまとめてあります。
安全性情報に関するお問い合わせ専用メールアドレス:med-anzen★ml.omu.ac.jp
変更申請に関するお問い合わせ専用メールアドレス:med-henko★ml.omu.ac.jp
※メールアドレスの★を@に変更してから送信してください。
関連資料
参考情報
- 随時掲載します